










Las reacciones químicas


Además
de
conocer
el
número
de
moléculas
de
cada
sustancia
que
reaccionan
o
se
producen
en
el
transcurso
de
la
reacción
química,
es
posible
establecer
otras
interpretaciones
cuantitativas
a
patir
de
la
ecuación
ajustada.
Así,
considerando
que
el
mol
es
la
magnitud
del
Sistema
Internacional
para
expresar
cantidad
de
materia,
y
que
1
mol
de
cualquier
sustancia
equivale
siempre
a
6,022
·
10
23
partículas
de
la
misma,
podemos
escribir,
observando los coeficientes estequiométricos, la siguiente interpretación cuantitativa:
Pero
todavía
queda
una
relación
más
por
obtener,
la
relación
de
estequiometría
en
masa
,
quizás
la
más
importante,
pues
permite
realizar
cálculos
de
cantidades
reaccionantes
o
producidas
en
los
procesos
tanto
de
laboratorio
como
industriales.
Pero
para
obtener
esta
última
relación
es
preciso
calcular
previamente
la
masa
molecular de cada sustancia. Fíjate cómo se hace:

•
Consultando
la
tabla
periódica,
obtenemos
las
masas
atómicas
de
los
elementos
que
participan en la reacción, expresadas en unidades de masa atómica (u).
Carbono - Masa atómica C = 12u
Hidrógeno - Masa atómica H = 1u
Oxígeno - Masa atómica O = 16 u
•
Con estos datos, calculamos la masa molecular de cada sustancia:
Masa molecular C
2
H
6
= 2 át C · 12 u + 6 át de H · 1 u = 30 u
Masa molecular O
2
= 2 át O · 16 u = 32 u
Masa molecular CO
2
= 1 át C · 12 u + 2 át de O · 16 u = 44 u
Masa molecular H
2
O = 2 át H · 1 u + 1 át de O · 16 u = 18 u
•
Si
la
masa
molecular
es
la
masa
de
una
molécula,
expresada
en
unidades
de
masa
atómica,
la
masa
molar
es
la
cantidad
en
gramos
de
sustancia
que
corresponde
a
1
mol
de la misma. Ambos datos coinciden numéricamente, por lo que podemos decir:
Masa molar C
2
H
6
= 30 g/mol
Cada 30 gramos de C
2
H
6
tenemos 1 mol
Masa molar O
2
= 32 g/mol
Cada 32 gramos de O
2
tenemos 1 mol
Masa molar CO
2
= 44 g/mol
Cada 44 gramos de CO
2
tenemos 1 mol
Masa molar H
2
O = 18 g/mol
Cada 18 gramos de H
2
O tenemos 1 mol
•
Una
vez
que
hemos
calulado
la
masa
molar
de
cada
sustancia,
y
teniendo
en
cuenta
que
si
reaccionan
2
moles
de
C
2
H
6
con
7
moles
de
O
2
se
producen
4
mol
de
CO
2
y
6
moles
de H
2
O, podemos escribir esta relación de estequiometría en masa, del siguiente modo:
REACTIVOS
2 moles de C
2
H
6
corresponden a .... 2 mol · 30 g/mol = 60 g C
2
H
6
7 moles de O
2
corresponden a ........ 7 mol · 32 g/mol = 224 g O
2
PRODUCTOS
4 moles de CO
2
corresponden a ...... 4 mol · 44 g/mol = 176 g CO
2
6 moles de H
2
O corresponden a ...... 6 mol · 18 g/mol = 108 g H
2
O
Estas
relaciones
se
pueden
utilizar
para
realizar
interesantes
cálculos
estequiométricos
.
Estudia
con
atención
los
ejemplos
que
aparecena
continuación:
Relaciones de estequiometría



Cada
2
moles
de
etano
(C
2
H
6
)
que
reaccionan
con
7
moles
de
oxígeno
(O
2
)
,
se
producen
4
moles
de
dióxido
de
carbono
(
CO
2
)
y
6 moles de agua (H
2
O)
.



Cada
60
g
de
etano
(C
2
H
6
)
que
reaccionan
con
224
g
de
oxígeno
(O
2
)
,
se
producen
176
g
de
dióxido
de
carbono
(
CO
2
)
y
108 g de agua (H
2
O)
.

Aunque
no
debes
olvidar
que
tanto
esta
relación
como
las
anteriores
expresan
la
PROPORCIÓN
en
moléculas, moles o gramos en que reaccionan las sustancias que participan en la reacción.




Cálculo de la relación de estequiometría en masa


¿A partir de cuántos moles de etano (C
2
H
6
) se obtendrán
60 moles de dióxido de carbono (CO
2
)?

Utilizando
la
relación
de
estequiometría
en
términos
de
moles,
planteamos
las
relaciones
de
proporcionalidad
entre
el
etano
y
el dióxido de carbono:
Resolviendo,
obtendremos
que
se
necesitan
30
moles
de
C
2
H
6
para que se obgtengan 60 moles de CO
2
.

Si reaccionan 672 gramos de oxígeno (O
2
) ¿Qué
cantidad de agua (H
2
O) se obtendrá tras el proceso?
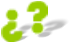
Utilizando
la
relación
de
estequiometría
en
términos
de
moles,
planteamos
las
relaciones
de
proporcionalidad
entre
el
etano
y
el dióxido de carbono:
Resolviendo,
obtendremos
que
se
producen
324
gramos
de
H
2
O a partir de 672 gramos de O
2
.
Si tras la reacción se han obtenido 48 moles de agua
(H
2
O), ¿qué cantidad de dióxido de carbono (CO
2
) se
habrá obtenido también?

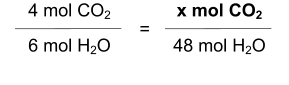
Utilizando
la
relación
de
estequiometría
en
términos
de
moles,
planteamos
las
relaciones
de
proporcionalidad
entre
el
dióxido
de carbono y el agua:
Resolviendo,
obtendremos
que
se
producen
32
moles
de
CO
2
además de los 48 moles de H
2
O.
¿Qué cantidad de oxígeno (O
2
) se necesita para que
reaccionen completamente 470 gramos de etano (C
2
H
6
)?

Utilizando
la
relación
de
estequiometría
en
masa,
planteamos
las
relaciones
de
proporcionalidad
entre
las
sustancias
implicadas, en este caso el etano y el oxígeno:
Resolviendo,
obtendremos
que
se
necesitan
1754,7
gramos
de
O
2
para que reaccionen los 470 gramos de C
2
H
6
.

Estás en: Inicio > Materiales > Aplicaciones> Las reacciones químicas




