Estás en: Inicio > Materiales > Aplicaciones> Las reacciones químicas






Las reacciones químicas


Detrás
de
este
artículo
de
uso
cotidiano
se
esconde
una
reacción
química,
conocida
desde
el
siglo
XIX.
Hoy
día,
las
pilas
se
han
convertido
en
objetos
imprescindibles
que
proporciona la corriente que usan muchos de nuestros apartatos eléctricos.


La pila química

•
Una
pila
salina
es
un
pequeño
depósito
de
cinc
recubierto
de
plástico
con
una
barrita
de
grafito
en
su
centro
y
relleno
de
una
pasta
húmeda
que
contiene
dióxiodo de manganeso, dicloruro de cinc y cloruro amónico.
Así ocurre …
•
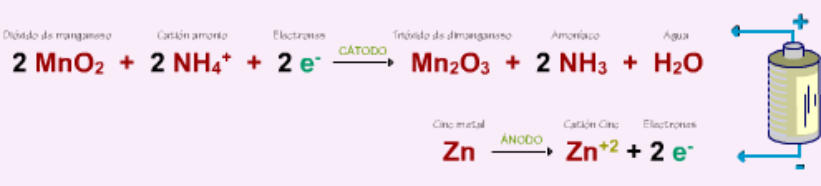
El
polo
positivo
de
la
pila
o
cátodo
es
la
barra
de
grafito,
sobre
la
cual
se
reduce
(gana
electrones)
el
manganeso,
transformándose
el
dióxido
de
manganeso en trióxido de dimanganeso.

La electricidad portátil
Las
pilas
permiten
el
funcionamiento
de
gran
cantidad
de
pequeños
aparatos,
como
radios,
relojes
y
calculadoras.
A
la
primera
pila
comercial,
ideada
por
Leclanché
y
Féry,
le
han
seguido
la
pila
alcalina
-que
contiene
un
hidróxido
de
un
metal
alcalino,
en
lugar
de
cloruro
amónico-
y
las
pilas
de
botón,
que
contienen
mercurio,
plata
o
litio,
y
son
de
larga
duración.
Las
baterías
o
acumuladores,
como
las
de
los
coches,
son
también
pilas,
pero
tienen
la
característica
de
que
pueden
regenerarse
una
vez
agotados
los
reactivos
pasando
una
corriente
eléctrica
a
través
de
ellas,
para
producir
la
reacción química inversa.
•
El
polo
negativo
o
ánodo
es
el
recipiente
de
cinc,
el
cual
se
oxida
(pierde
electrones),
transformándose
en
ion
Zn
2+
,
que
se
une
al
amoníaco
procedente
del
cloruro
amónico.
Los
electrones
intercambiados
en
el
proceso
forman
la
corriente eléctrica producida por la pila.