










Las reacciones químicas


Observa los pasos necesarios para llevar a cabo el ajuste de la siguiente ecuación química:
Ajuste e interpretación de ecuaciones químicas

Interpretación
El hidrógeno (H
2
) y el nitrógeno (N
2
) reaccionan entre sí para formar amoníaco (NH
3
), y lo
hacen en la siguiente proporción:

Para
ajustar
una
reacción,
debemos
conseguir
que
el
número
de
átomos
de
cada
elemento
sea
el
mismo
antes
y
después
de
la
reacción.
En
este
caso,
debe
haber
los
mismos
átomos
de
H
y
de
N
en
los
reactivos
y
en
los
productos.

Por
tanto,
comenzamos
dibujado
una
molécula
de
hidrógeno
(H
2
),
una
de
nitrógeno
(N
2
)
y
una
de
amoníaco
(NH
3
),
y
hacemos
un
primer
recuento
de
los
átomos
que
hay
antes
y
después de la reacción.
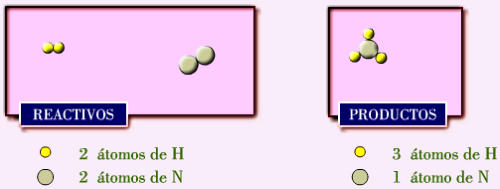
Como
el
número
de
átomos
de
cada
elemento
en
reactivos
y
productos
debe
ser
el
mismo,
y
no
es
así,
donde
nos
falten
átomos
debemos
añadir
las
moléculas
necesarias
para
equilibrar
las
cantidades.
Para
ello,
habremos
de
añadir
dos
moléculas
más
de
hidrógeno
(H
2
)
en
los
reactivos,
y
una
molécula
ádicional
de
amoníaco
(NH
3
)
en
los
productos.
Hecho
esto,
modificamos
en
consecuencia
el
coeficiente
estequiométrico
de
cada una de las sustancias en función de las moléculas añadidas:
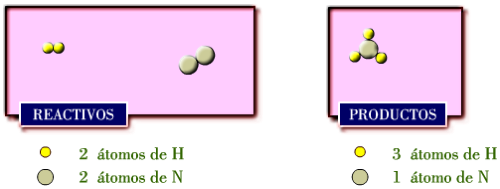
Una
vez
la
reacción
ya
esté
ajustada
-porque
tenemos
el
mismo
número
de
átomos
de
cada
elemento
antes
y
después
de
la
misma-,
sólo
queda
realizar
una
interpretación
del
proceso.
Para
ello,
expresaremos
microscópicamente
lo
que
está
ocurriendo,
indicando
las
moléculas
implicadas
de
cada
una
de
las
sustancias,
de
acuerdo
con
los
correspodientes coeficientes estequiométricos.


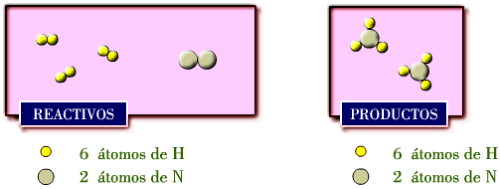
Cada 3 moléculas de hidrógeno que reaccionan con 1
molécula de nitrógeno producen 2 moléculas de amoníaco.



Estás en: Inicio > Materiales > Aplicaciones> Las reacciones químicas



