





Las reacciones químicas







Fíjate en la siguiente ecuación química, y observa cómo se deducen los coeficientes estequiométricos:
Ajuste e interpretación de ecuaciones químicas

Interpretación
El amoníaco (NH
3
) y el oxígeno (O
2
) reaccionan entre sí para formar nitrógeno (N
2
) y
agua (H
2
O), y lo hacen en la siguiente proporción:
Para
comenzar
el
ajuste
dibujamos
una
molécula
de
cada
sustancia
según
corresponda.
Hecho
esto,
se
realiza
un
primer
recuento
de
átomos
de
cada
elemento,
para
ver
la
diferencia
que
existe
en
la
proporción
de
cada
uno
entre
reactivos y productos.

LLegados
a
este
punto
es
cuando
debemos
tratar
de
igualar
el
número
de
átomos
de
cada
elemento,
añadiendo
las
moléculas
necesarias
de
las
sustancias
indicadas
(en
reactivos
o
en
productos,
según
sea
necesario).
En
este
caso,
conseguiremos
ajustar
el
proceso
haciendo
reaccionar
4
moléculas
de
amoníaco
(NH
3
)
con
3
moléculas
de
oxígeno
(O
2
).
Para
que
el
número
de
átomos
de
cada
elemento
sea
el
mismo,
habrá
que
colocar
en
los
productos
2
moléculas
de
nitrógeno
(N
2
)
junto
con
6
moléculas
de
agua (H
2
O):


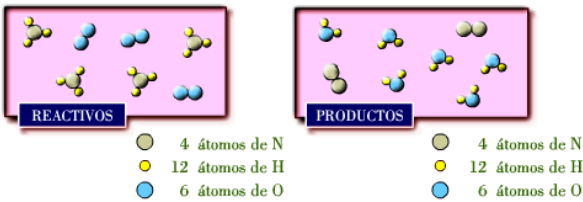
Cada 4 moléculas de amoníaco que reaccionan con 3 moléculas de
oxígeno producen 2 moléculas de nitrógeno y 6 moléculas de agua.






Estás en: Inicio > Materiales > Aplicaciones> Las reacciones químicas



